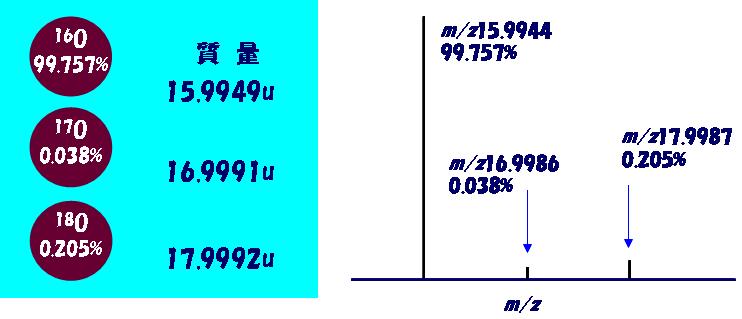
図1 酸素には3つの安定同位体 16O、17O、18Oがあり、それぞれが異なる質量を持っている。
分子量が大きくなると同位体ピークが大きくなる理由について
このことも、質量分析を理解するうえでの出発点です。しかしながら、分子量と質量の違いと同様、誰も教えてくれません。図2に示した、CH4O、C50H102O、C100H202O等を例にわかりやすく説明します。
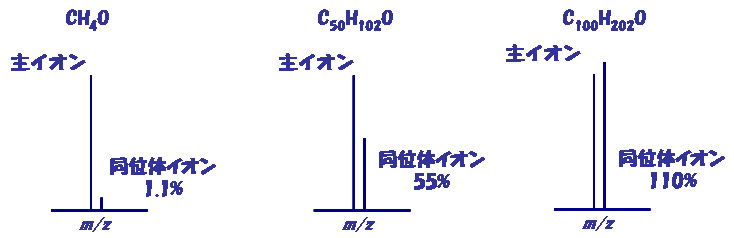
図2 炭素には2つの安定同位体 12C、13Cがあり、その存在比率は、98.9%と1.1%である。従って、C50の化合物では同位体ピークは55%、C100では110%となる。
試料の調製に必要な単位について
質量分析を行うときに必要な試料の調製には、様々な単位がついて回ります。重量の単位の g、mg、μg、ng、pg、fg、ag、zg、主に気体中や固体中の濃度を示す %、ppm、ppb、ppt、物質量を表す mol、mmol、μmol、nmol、pmol、fmol、amol、zmolと、これを使ったmol/Lといった濃度表現です。きっちり整理しておかないと、頭の中が『ごちゃごちゃ』になってしまいます。これらについても解説します。
酸性官能基、塩基性官能基、極性
試料の調製や前処理、イオン化法の選択に重要な事柄です。わかりやすく解説します。
市販の質量分析計の種類について
四重極質量分析計、飛行時間質量分析計、イオントラップ質量分析計、磁場型質量分析計、フーリエ変換イオンサイクロトロン共鳴質量分析計と、それらをつないだMS/MSが市販されています。あまりにも種類が多いので、きっちり整理しておく必要があります。これらについても解説します。
SED Science Esucation 代表取締役社長: 平山 和雄
|
|
| Copyright (C) Science Education Co., Inc. All Rights Reserved. |